Luis D. Barja1, Gerson A. Revollo2, Juan M. Aboy2, Mariela Palavecino3
* Autores no reportan conflicto de interés
1. Jefe de servicio de Electrofisiología. Hospital Universitario Austral. Buenos Aires Argentina
2. Staff de Electrofisiología. Hospital Universitario Austral. Buenos Aires Argentina
3. Técnica en prácticas cardiológicas. Hospital Universitario Austral. Buenos Aires Argentina
Resumen. Hay evidencia que los focos extra venas pulmonares (VPs) tienen un rol beneficioso en el caso que sean ablacionados tanto en la fibrilación auricular (FA) paroxística como en FA persistente. La vena cava superior (VCS), uno de estos gatillos, aumenta la efectividad de la ablación de la FA en un 6 al 8%. En los últimos años la utilización del catéter de mapeo de alta densidad para evaluar sustratos arritmogénicos y los GAPs en el aislamiento de las VPs , ha demostrado una alta efectividad sin embargo no se ha utilizado para el aislamiento de la VCS.
Objetivos. Evaluar la efectividad y utilidad del catéter de alta densidad para el mapeo de la VCS: Tipo de aislamiento circunferencial o segmentario realizado, su localización, relación con mapa de voltaje, localización del nervio frénico (NFr) y bloqueo bidireccional objetivo.
Métodos. Estudio observacional retrospectivo (junio 2020 a marzo 2022), unicéntrico. Se incluyeron 17 pacientes (pts) (14 varones), edad promedio 55 años,6 pts. tenían FA paroxística (35.3%) y 10 pts. FA persistente (57.8%) que ingresaron en ritmo sinusal. Se realizó aislamiento de VCS en asociación a AVP, líneas y otras técnicas según el tipo de FA con sistema de navegación EnSite Precisión y catéter irrigado abierto con fuerza de contacto (Abbott). Además, se realizó mapa de voltaje y ubicación del NFr. Posteriormente se efectuó ablación segmentaria o circunferencial del gap de entrada auricular derecha (AD)-VCS y nuevo mapa de voltaje para confirmación del bloqueo efectivo.
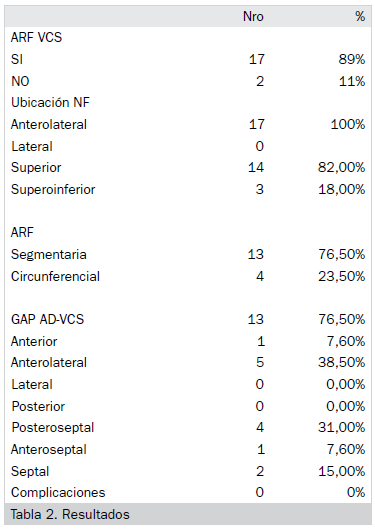
Resultados. De los 17 pacientes que cumplieron criterios de voltaje/potenciales adecuados se observó :1. En 13 pacientes (grupo GAP) (76,5%) se evidenció 1/2 gap constante cuya ubicación fue: 1 anterior (7,6%), 5 anterolaterales (38,5%), 4 postero septales (31%), 1 anteroseptal (7,6%) y 2 septales (15%) de la unión de VCS-AD. De este grupo se ablacionaron 12 pacientes sobre éstos gap de conducción, un paciente no fue efectivo y uno se abortó por defecto de estimulación del NFr. El resto, 4 pacientes (Grupo NO gap) no evidenciaron una clara zona de gap. A éstos se realizó ablación circunferencial, con imposibilidad de finalizar en uno de ellos por cercanía del NFr derecho, con 75% de efectividad final en este subgrupo. De los 17 pacientes sometidos a ablación en 2 pts. no fue efectiva la ablación (88% de efectividad total). 2. El “sitio anatómico del nervio frénico” se ubicó en la región anterolateral en 17 pacientes, 14 (82%) en zona superior o en VCS y 3 (18%) inferior más hacia la AD. De los 13 con GAP solo 5 coincidieron con la zona antero latero superior y 1 sólo de ellos no pudo realizarse la ablación por desaparición de la estimulación durante la aplicación. Ningún paciente presentó complicaciones.
Conclusiones. La utilización del catéter de alta densidad HDGrid (SJM-Abbott) para el aislamiento de la VCS es efectivo para reconocer rápidamente los gaps únicos entre la VCS y la AD en 13 de los 17 pacientes ingresados, así como localizar el nervio frénico por mapeo de estimulación y la demostración del aislamiento con bloqueo bidireccional a través de los mapas de voltaje (82% de efectividad total).
Palabras Clave. Mapeo alta densidad, gatillos extrapulmonares, ablación FA
High Density Mapping Catheter To Isolate The Superior Cava Vein In Atrial Fibrillation Ablation.
Abstract. Evidence shows that radiofrecuency catheter ablation of ectopic foci of pulmonary veins (PV) could have a beneficial outcome in patients with symptomatic paroxysmal-persistent atrial fibrillation. The superior cava vein (SCV) is a trigger that increases the efficiency of the atrial fibrillation ablation 6 to 8%. In recent years the use of High density mapping catheter to evaluate the arrhythmogenic substrate and the gaps in the isolation of the pulmonary veins has shown a high efficiency, nevertheless it hasn’t been used for the isolation of superior cava vein.
Objetives. Evaluate the efficency and utility of high density mapping catheter of the superior cava vein. The type of isolation circunferential or segmentary accomplished, it’s localization, its relation with the voltage map, localization of the phrenic nerve (FN) and the objective bidirectional blockage.
Methods. A unicentric retrospective observational study during June 2020 and march 2022. The study included 17 patients of both sexes (14 men) average age 55 years, 6 with paroxysmal atrial fibrillation (35.5%) and 10 with persistent atrial fibrillation (57.8%) who had sinus rhythm at the moment of the ablation. The superior cava vein was isolated in association with the pulmonary vein and another techniques according to the atrial fibrillation type with EnSite precision navigation system with the tacticath contact force ablation catheter (Abbott). In addition, the realization of voltage mapping and the localization of the phrenic nerve. Subsequently the segmentary or circunferential ablation of the gap entrance of the right atria and superior cava vein and then a new voltage mapping to confirm the effective blockage.
Results. Of the 17 patients that met criteria of voltage and the electrograms (EGM) we observed that 13 patients (gap group) 76,5% had 1-2 gaps located 1 anterior (7,6%), 5 anterolateral (38,5%), 4 postero septal (31%), 1 anteroseptal (7,6%) and 2 septal (15%) of the junction of the right atria-superior cava vein. 12 patients of this group underwent ablation of the conduction gap, one was not effective, and another one couldn’t be ablationated because of a defect in the stimulation of the phrenic nerve. 4 patients of the NO gap group did not evidence a clear gap zone. This group received a circunferential ablation, except one, due to the proximity to the phrenic nerve, with an overall effectiveness of 75%. Of the 17 patients that underwent ablations, 2 were not effective, with an overall effective rate of 88%.
The anatomic site of the phrenic nerve was located in the anterolateral region in 17 patients, 14 (82%) in the superior region or in the superior cava vein and 3 (18%) inferior region to the right atria. Of the 13 patients with gap, only 5 shared the superior anterior lateral region and one of them couldn’t be ablationated due to the disappearance of the stimulation during the radiofrecuency ablation. No complications were reported.
CONCLUSIONS: The use of high density catheter mapping utilization (SJM-Abbott) to isolate de superior cava vein is effective to recognize quickly the gaps between the superior cava vein and the right atrium. 13 of the 17 patients included were able to localize the phrenic nerve by stimulation mapping and show a bidirectional blockage isolation with an 82% of total effectiveness.
rrespondencia: Luis D. Barja
Email: lbarja@gmail.com
Recibido: 12/05/2022 Aceptado: 22/06/2022
Introducción
Es conocido que el aislamiento objetivo de las venas pulmonares (VPs) es el punto final más fuerte de la ablación para el tratamiento de la fibrilación auricular (FA) paroxística incluso desde las guías del 2007, por ser las VPs el principal gatillo de estas arritmias. Existen otros gatillos heterópicos por fuera de las VPs como la vena cava superior (VCS), que pudiera ser la causante del inicio de este tipo de FA con una incidencia variables. Su aislamiento efectivo aumenta el éxito final del tratamiento entre un 6-8 % cuando se lo combina con el aislamiento de las VPs en pacientes con FA paroxísticas. Distintos métodos se han propuestos para la ablación de la VCS pero sin embargo su evaluación y aislamiento no está claro con las nuevas tecnologías como el mapeo con catéteres de alta densidad, que han mostrado buena efectividad en la ablación de las VPs, sobre todo en las re ablaciones en búsqueda de gaps, o reconexiones y en otros sustratos arrítmicos reentrantes.
La ablación circunferencial de la VCS puede por otro lado alterar estructuras contiguas extra cardíacas como el nervio frénico, su mapeo anatómico relacionado con los gaps de conexión puede evitar una complicación como la parálisis diafragmática.
Objetivos
El objetivo primario fue conocer la existencia de Gaps de conducción entre la VCS y aurícula derecha (AD), su relación con el sitio de aislamiento de VCS efectivo bajo el mapeo de alta densidad. El objetivo secundario fue conocer el sitio anatómico del nervio frénico derecho y su relación con esos sitios. La efectividad del método y la obtención del bloqueo bidireccional y la obtención de mapas que puedan objetivar el mismo.
Materiales y métodos
Se realizó un estudio descriptivo, retrospectivo, unicéntrico que incluyó pacientes atendidos de manera consecutiva desde junio del año 2020 a marzo de 2022 con diagnóstico de FA que concurrieron al servicio de electrofisiología para realizar una ablación de AVPs a los cuales se realizó además aislamiento de la VCS bajo sistema de Navegación EnSite Precision St. Jude con catéter de mapeo HD Grid St Jude y catéter de ablación irrigado y fuerza de contacto Tacticath St Jude (aplicaciones de FTI 300, CF >10) Los criterios de inclusión fueron pacientes de ambos sexos mayores de 18 años con diagnóstico de fibrilación auricular paroxística y o persistente sintomáticos, refractarios a medicación antiarrítmica, con ritmo sinusal al inicio del procedimiento. Los criterios de exclusión fueron pacientes menores de 18 años o mayores de 75 años, la imposibilidad de utilización de catéter de mapeo de alta densidad, pacientes con FA de larga duración o con FA de inicio, y cualquier contraindicación a la terapéutica de ablación.
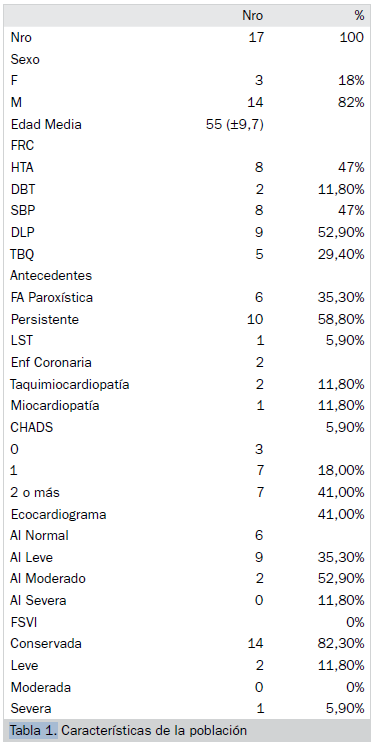
De 19 pacientes se excluyeron 2 por no demostrar potenciales. Las características basales de la población en estudio fue edad promedio de 55 años (±10 años), 14 varones y 3 mujeres, 6 pts presentaban FA paroxística (35,3%), 10 pts FA persistente (58,8%) y uno con FA persistente long standing (5,9%). Todos estaban refractarios a la medicación y anticoagulados previamente con dabigatrán según función renal y normativas de hematología. El 87% tenían aurícula izquierda (AI) normal a leve dilatación y solo uno presento disfunción ventricular izquierda severa. A ningún paciente se le suspendió el protocolo de anticoagulación previo al ingreso de la intervención (Tabla 1).
Definiciones
Ubicación anatómica del NFr: se definió como zona de la estimulación positiva del nervio con realización de un mapa de estimulación (Figura 1)
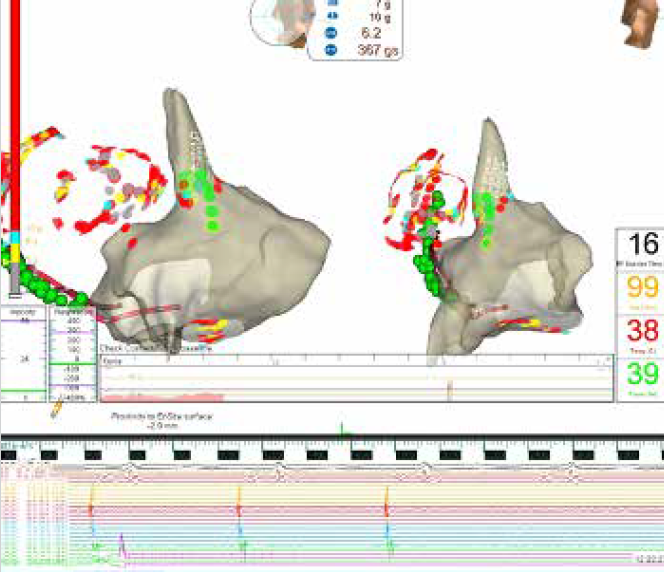
Aislamiento objetivo de la VCS: Se definió como el bloqueo bidireccional a través del istmo AD-VCS, con desaparición del pasaje de actividad eléctrica entre estas cámaras ante la estimulación de AD a VCS y de la VCS a AD. (Figura 2) Ablación segmentaria: Definido como ablación puntual sobre el Gap entre la VCS y AD y que no cubre la circunferencia de la VCS. (Figura 3) Ablación circunferencial: Definido como ablación lineal de toda la circunferencia de la VCS para producir el bloqueo bidireccional. (Figura 4) Criterio de potenciales de la VCS de interés: presencia de potenciales de 25mm de longitud y con 5mv de amplitud1,2 o con evidencia de gatillo de una FA.
Descripción del método de mapeo y ablación
A todos los pts se les realizó un aislamiento de las venas pulmonares con demostración de bloqueo bidireccional. Se continuó con la reconstrucción anatómica de la aurícula derecha, vena cava inferior (VCI) y de la VCS con sistema de navegación con la tecnología antes descripta, realizando mapa de voltaje y mapas de tiempo de activación con la confirmación de potenciales eléctricos en VCS y pasaje de actividad eléctrica bidireccional con la estimulación desde VCS/AD (Figura 2). Posteriormente se realizó un mapa de estimulación del nervio frénico en toda su extensión ante la presencia de estimulación positiva desde VCS hasta su desaparición en aurícula derecha (AD), con dibujo anatómico de su localización y su trayecto. Subsiguientemente se realizó ablación segmentaria a nivel antral en zona de Gap hasta su aislamiento (Figuras 3, 4), en caso de no producir el corte o no evidenciar el gap claro se realizó ablación circunferencial completa, con excepción de la zona de registro cercano al nervio frénico. Posteriormente se confirmó el bloqueo bidireccional con mapa de voltaje y estimulación desde la AD y VCS. Se evaluó la presencia o ausencia de Gap, sitio de aislamiento de VCS, localización del nervio frénico y necesidad de ablación circunferencial o segmentaria para el bloqueo bidireccional de la VCS.
Resultados
De una población de 19 pts con AVPs más aislamiento de VCS, 2 se excluyeron por no cumplir criterios de volteje incluso uno de ellos con aislamiento espontaneo. Los 17 pts restantes cumplieron con criterios de voltaje con potenciales de la VCS apropiados. En 13 de ellos (76,5%) se evidencio 1/2 gap constante cuya ubicación fue: 1 anterior (7,6%), 5 anterolaterales (38,5%), 4 postero septales (31%), 1 anteroseptal (7,6%), y 2 septales (15%) de la unión de VCS-AD (tabla 2). A estos se lo denomino grupo Gap y se ablacionaron 12 pts de manera exitosa sobre estos gaps de conducción (con estimulación del NFr derecho en las aplicaciones para evaluar su funcionamiento constante), un paciente no fue efectivo y uno no se completó la ablación por defecto de la estimulación del NFr. El resto, 4 pts (NO gap) no se evidencio una clara zona de gap o las mismas fueron alternantes ante el procedimiento inicial. A estos 4 pts se le realizó ablación circunferencial, con imposibilidad de finalizar en uno de ellos por cercanía del frénico derecho y desaparición de la estimulación ante la aplicación, 75% de efectividad final en este subgrupo. De los 17 pts sometidos a ablación en 2 pts no fue efectiva la misma, lográndose un 88% de efectividad total. El “sitio anatómico del nervio frénico” se ubicó en la región anterolateral en 17 pts, 14 (82%) en la zona superior o en VCS y 3 (18%) inferior más hacia la AD De los 13 pts con gaps solo 5 de ellos coincidieron con la zona antero latero superior y en 1 solo de ellos NO se pudo realizar ablación por desaparición de la estimulación durante la aplicación. Ningún paciente presento complicaciones (Tabla 2).
Discusión
La estrecha relación anatómica y la conectividad de la VCS con la AD hace que esta cavidad sea de interés en el tratamiento intervencionista de la FA. Sin embargo, estructuras como el NFr discurren a lo largo de la VCS, pudiendo ser lesionado durante la ablación y presentar como complicación parálisis diafragmática. El conocimiento de la estructura de la VCS es fundamental para un especialista. La VCS está formada por la unión de las venas innominadas iniciadas por debajo del cartílago de la primera costilla a nivel del esternón y llega hasta la unión de la AD. Presenta una longitud de 6,8 cm (4,4 cm – 10 cm). Se relaciona anteriormente con el pulmón y pleura derecha, posteriormente con la vena pulmonar superior derecha, a la izquierda con la arteria innominada, aorta ascendente y a la derecha con el nervio frénico y pleura, por debajo con el haz muscular precava (Figura 1).
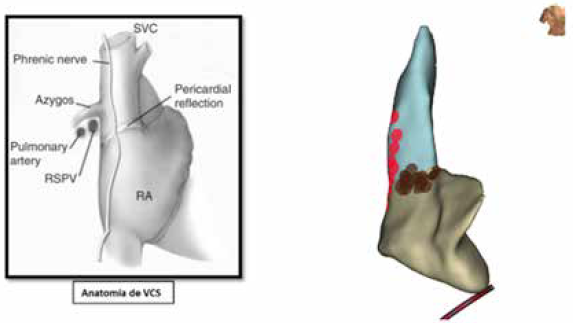
Figura 1. A la izquierda imagen de la anatomía de la VCS AD y NFr derecho.
A la derecha verismo anatómico (azul VCS, gris AD, puntos rojos
ubicación del NFr demostrada por estimulación diafragmática,
puntos marrones sitios de aplicación en la zona ostial de la VCS).
Figura 2. Imagen anatómica de la VCS donde se evidencia su aislamiento,unidireccional eneste caso, durante
la ablación (ver electrogramas intracavitarios abajo). Los puntos verdes dentro de la AD,sobrelaVCS es laubicación
del NFr, los puntos rojos corresponden a los sitios de aplicación y el azul sitio de aislamientoen ese casocircunferencial.
Los Puntos fuera de la imagen de VCS y AD son los de aplicaciones en VPs, SC, y líneas en la AI.
El haz muscular precava es un reborde muscular ubicado entre a VCS y AD que se inicia en la parte anteromedial y llega hasta la pared medial o septal. La unión posterior entre la VCS y AD emerge de forma imperceptible sin embargo en la pared anterior forma un ángulo. Embriológicamente la VCS presenta extensiones musculares provenientes de la AD mayormente en embriones y niños que en adultos, además es rico en plexos parasimpáticos. El nervio frénico derecho discurre a nivel lateral de la VCS y AD pasando por el reborde muscular anterior con una variación de contacto con estas estructuras1. La VCS demostró ser un foco extrapulmonar desencadenante de FA entre un 6 al 8%2-5 por lo cual el aislamiento de la VCS mejora el mantenimiento del ritmo sinusal a largo plazo. Incluso algunos autores han indicado las características que deben de tener esos potenciales para ser tomados en cuenta 6. En la guía de FA ESC 20207 no está justificada el uso de la ablación de focos extrapulmonares, incluido el aislamiento de VCS en pacientes con FA persistente y long standing, durante el primer procedimiento. Sin embargo, estudios de control randomizados sugieren mejoría de los resultados con la ablación de focos extrapulmonares. En la guía Venice Chart on AF Ablation 2011 la ablación de focos extrapulmonares es recomendada8. En otro estudio randomizado que evaluó el impacto del aislamiento sistemático de la VCS en adición a la AVP con catéter circular, en pacientes con FA paroxística, persistente, realizado por Dr. Andrea Corrado y col. se observó a los 12 meses mejoría de los resultados solo en aquellos pacientes con FA paroxística (P: 0.04)5. Sin embargo, no está exento de complicaciones como lesión del nervio frénico y lesión del nodo sinusal. En nuestro estudio la ubicación anatómica del NFr derecho sobre el sector anterolateral se relacionó en 5 pacientes, en esa misma zona de los gaps de ubicación anterolateral, como punto a ablacionar, el resto los gap no se relacionaron con el Nfr. De los que tenían una conexión “circular” uno no se pudo realizar por desaparición de la estimulación en esa área.
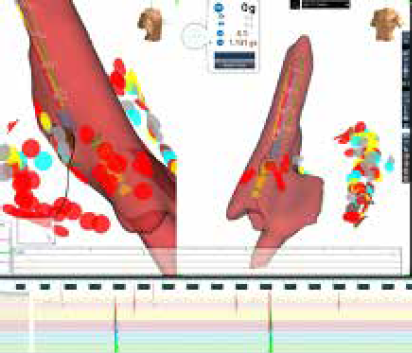
Figura 3. A la izquierda se observa gap de la conexión entre la VCS y la AD
(zona blanca) nótese el catéter de ablación en el mismo sitio.
A la derecha mapa anatómico con líneas verticales del Nfr. En la parte inferior
se observanelectrogramas intracavitarios con conexión entre VCS – AD y a
la derecha de la imagen potenciales de la VCS aislados de las aurículas.
El uso de crioablación con balón circunferencial no puede distinguir detalles de ubicación del frénico para evitarlo, obligando al cese de la aplicación en caso de pérdida de la estimulación del frénico. En el estudio publicado recientemente por el Dr. Lacopino y col. utilizando catéteres de segunda generación, se observó que la ablación de la VCS asociada a aislamiento de VPs fue efectiva en 37 pts con FA paroxística. Sin embargo 2 pts presentaron parálisis transitoria del nervio frénico y en 3 pts por evidencia de daño inminente se suspendió la crioablación9. El catéter HDGrid Advisor (Abbott-SJ) es un catéter de alta densidad de muestreo, que mapea en forma rectangular
con 16 electrodos (Figuras 2 y 3), distribuidos en cuatro líneas de 4 electrodos con una distancia intercalada de 3 mm. El registro eléctrico se adquiere a lo largo y a través de los electrodos adyacentes generando la visualización de la señal eléctrica máxima y la dirección del frente de onda10. Se ha utilizado para la confirmación de una ablación incompleta de ICT con evidencia de potenciales de alta frecuencia y baja amplitud que sirvió como guía para la ablación efectiva11 y reconexión de VP por su fácil reconocimiento de electrogramas locales no visibles con otros catéteres demostrando el beneficio de su utilidad. Sin embargo, esta tecnología no ha sido demostrada ni utilizada en el aislamiento de la VCS 10. La asociación con nuevos programas como la visualización en tiempo real con mapas dinámicos (Dynamcic Map , Real Time con el HDGrid Advisor Abbott) sin duda mostrará rápidamente estos gaps , con la posibilidad de acortar tiempos y visualizar su efectividad de manera inmediata latido a latido.
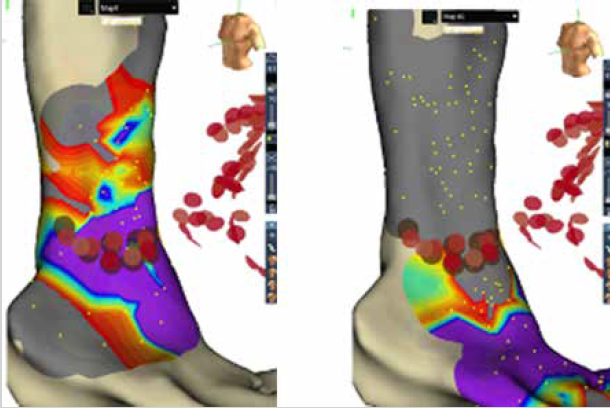
Figura 4. Ablación circunferencial, grupo sin gap evidente. A la izquierda mapa
LAT pre ablación. A la derecha mapa de voltaje post ablación, zona gris ausencia de potenciales.
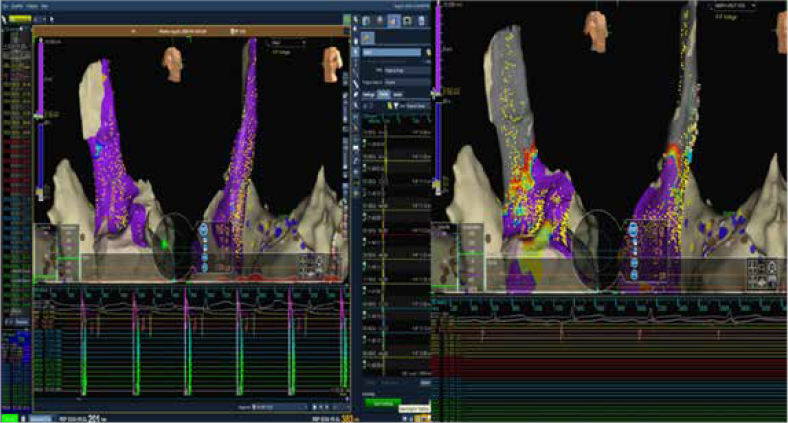
Figura 5. Mapa de voltaje con demostración de aislamiento. A la izquierda pre ablación conpotenciales dentro de la VCS
(zona violeta) y su correlación con los electrogramas intracavitarios (imagen inferior izquierda). A la derecha mapapostablación
sin potenciales (zona gris) y su correlato con la ausencia de electrogramas intracavitarios (imagen inferior derecha).
Conclusiones
La utilización del mapeo con catéter de alta densidad para el aislamiento de la VCS fue efectivo para reconocer rápidamente los gaps únicos entre la VCS y la AD en 13 de los 19 pts ingresados. Su ubicación coincidió en 5 pts con gaps anterolaterales, en el resto presento gaps en otras zonas no relacionadas con el NFr derecho. La ablación fue efectiva logrando bloqueo bidireccional en el 82% del total de pacientes ingresados, en general suspendida por la inmediatez del NFr. La demostración del aislamiento a través de los mapas de voltaje confirma el aislamiento bidireccional efectivo de la VCS.
Referencias
1. Chen S, Haïssaguerre M. Zipes D. En: Thoracic Vein Arrhythmias. Wiley-Blackwell Publishing Año 2004.
2. Lin WS, Tai CT, Hsieh MH, et al. Catheter ablation of paroxysmal atrial fibrillation initiated by non-pulmonary vein ectopy. Circulation
3. Shah D, Haissaguerre M, Jais P, et al. Nonpulmonary vein foci: Do they exist?. Pacing Clin Electrophysiol 2003;26(7Pt 2):1631-1635.
4. Goya M, Ouyang F, Ernst S, et al. Electroanatomic mapping and catheter ablation of breakthroughs from the right atrium to the superior
vena cava in patients with atrial fibrillation. Circulation 2002;106:1317- 1320.
5. Corrado A, Bonso A Madalosso, et al. A Impact of Systematic Isolation Of Superior Vena Cava In Addition To Pulmonary Vein Antrum
Isolation On The Outcome Of Paroxysmal, Persistent, And Permanent Atrial Fibrillation Ablation: Results From A Randomized Study. J Cardiovascular Electrophysiologic 2010; 21: 1-5
6. Koji Higuchi, Yaseteru Yamauchi, Knezo Hirao. Superior Vena Cava Isolation In Ablation of Atrial Fibrillation (Review) . J Atr Fibrillation 2014 Jun 30;7(1):1032
7. Gerhard Hindricks, Tatjana Potpara, Nikolaos Dagres, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation
developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021 Feb 1;42(5):373-498
8. Raviele A, Natale A, Calkins H, Camm J, Cappato R, et al. Venice Chart International Consensus Document on Atrial Fibrillation Ablation: 2011 Update. J Cardiovasc Electrophysiol, Vol. 23, pp. 890-923, August 2012.
9. Iacopino S, Guimarães Osório T, Filannino P, et al. Safety and feasibility of electrical isolation of the superior vena cava in addition to pulmonary vein ablation for paroxysmal atrial fibrillation using the cryoballoon: lessons from a prospective study. J Interv Card Electrophysiol, 2021 Mar;60(2):255-260.
10. Yeo C, Tan V, Wong K. Pulmonary vein reconnection mapping with Advisor HD Grid demonstrating local EGM which were not visible on Tacticath ablation catheter. J Arrhythm. 2019 Feb; 35(1): 152–154.
11. Frisch D. Identifying a Gap in a Cavotricuspid Isthmus Flutter Line Using the Advisor™ HD Grid High-Density Mapping Catheter. J Innov Card Rhythm Manag. 2019 Dec; 10(12): 3919–3922.